TABLA PERIÓDICA DE LOS ELEMENTOS
La tabla periódica de los
elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
En palabras de Theodor Benfey, la tabla y la ley periódica «son el corazón de la química —comparables a la teoría de la evolución en biología (que sucedió al concepto de la Gran Cadena del Ser), y a las leyes de la termodinámica en la física clásica».2
Las filas de la tabla se denominan períodos y las columnas grupos. Algunos grupos tienen nombres. Así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares. Debido a que las posiciones están ordenadas, se puede utilizar la tabla para obtener relaciones entre las propiedades de los elementos, o pronosticar propiedades de elementos nuevos todavía no descubiertos o sintetizados. La tabla periódica proporciona un marco útil para analizar el comportamiento químico y es ampliamente utilizada en química y otras ciencias.
Dmitri Mendeléyev publicó en 1869 la primera versión de tabla periódica que fue ampliamente reconocida. La desarrolló para ilustrar tendencias periódicas en las propiedades de los elementos entonces conocidos, al ordenar los elementos basándose en sus propiedades químicas,3 si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos.4 Mendeléyev también pronosticó algunas propiedades de elementos entonces desconocidos que anticipó que ocuparían los lugares vacíos en su tabla. Posteriormente se demostró que la mayoría de sus predicciones eran correctas cuando se descubrieron los elementos en cuestión.
La tabla periódica de Mendeléyev ha sido desde entonces ampliada y mejorada con el descubrimiento o síntesis de elementos nuevos y el desarrollo de modelos teóricos nuevos para explicar el comportamiento químico. La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. Existen además otros arreglos periódicos de acuerdo a diferentes propiedades y según el uso que se le quiera dar (en didáctica, geología, etc).5
Se han descubierto o sintetizado todos los elementos de número atómico del 1 (hidrógeno) al 118 (oganesón); la IUPAC confirmó los elementos 113, 115, 117 y 118 el 30 de diciembre de 2015,6 y sus nombres y símbolos oficiales se hicieron públicos el 28 de noviembre de 2016.1 Los primeros 94 existen naturalmente, aunque algunos solo se han encontrado en cantidades pequeñas y fueron sintetizados en laboratorio antes de ser encontrados en la naturaleza.n. 1 Los elementos con números atómicos del 95 al 118 solo han sido sintetizados en laboratorios. Allí también se produjeron numerosos radioisótopos sintéticos de elementos presentes en la naturaleza. Los elementos del 95 a 100 existieron en la naturaleza en tiempos pasados pero actualmente no.7 La investigación para encontrar por síntesis nuevos elementos de números atómicos más altos continúa.
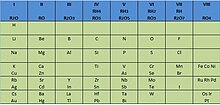
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Bloque | s | d | p | |||||||||||||||
| ↓Período | ·El helio pertenece al bloque s | |||||||||||||||||
| 1 | 1 H | 2 He· | ||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe |
| 6 | 55 Cs | 56 Ba | 57-71 * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
| 7 | 87 Fr | 88 Ra | 89-103 ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Nh | 114 Fl | 115 Mc | 116 Lv | 117 Ts | 118 Og |
| Bloque | f | d | |||||||||||||||
| * | Lantánidos | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |
| ** | Actínidos | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | |
| Leyenda | Estado de agregación de la materia a 0°C y 1 atm (Según el color del número atómico) | ||||
| 1 H | <- Número atómico | Rojo | Azul | Negro | Gris |
| <- Símbolo químico | Gaseoso | Líquido | Sólido | Desconocido | |
| Metales | Metaloides | No metales | |||||||
| Alcalinos | Alcalino- térreos | Lantánidos | Metales de transición | Otros metales | Otros no metales | Halógenos | Gases nobles | ||
| Actínidos | |||||||||
Para una versión más detallada de la tabla periódica con hipertexto, consúltese Anexo:Tabla periódica.
Índice
[ocultar]- 1Historia
- 1.1Descubrimiento de los elementos
- 1.2Noción de elemento y propiedades periódicas
- 1.3Los pesos atómicos
- 1.4Primeros intentos de sistematización
- 1.5Ley de las octavas de Newlands
- 1.6Tabla periódica de Mendeléyev
- 1.7Segunda tabla periódica de Mendeléyev y desarrollos posteriores
- 1.8Mecánica cuántica y expansión progresiva de la tabla
- 2Estructura y organización de la tabla periódica
- 3Otras formas de representar la tabla periódica
- 4Preguntas abiertas y controversias
- 5Elementos
- 6Véase también
- 7Notas
- 8Referencias
- 9Bibliografía
- 10Enlaces externos
Historia[editar]
La historia de la tabla periódica está íntimamente relacionada con varios aspectos del desarrollo de la química y la física:
- El descubrimiento de los elementos de la tabla periódica.
- El estudio de las propiedades comunes y la clasificación de los elementos.
- La noción de masa atómica (inicialmente denominada «peso atómico») y, posteriormente, ya en el siglo xx, número atómico.
- Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos y la aparición de nuevos elementos.
Descubrimiento de los elementos[editar]
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo xvii, cuando el alquimista Henning Brand descubrió el fósforo (P).9 En el siglo xviii se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo xix, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo xix, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc. Durante el siglo xx, la investigación en los procesos radioactivos llevó al descubrimiento en cascada de una serie de elementos pesados (casi siempre sustancias artificiales sintetizadas en laboratorio, con periodos de vida estable muy cortos), hasta alcanzar la cifra de 118 elementos con denominación oficialmente aceptados por la IUPAC en noviembre de 2016.1
Noción de elemento y propiedades periódicas[editar]
Lógicamente, un requisito previo necesario a la construcción de la tabla periódica era el descubrimiento de un número suficiente de elementos individuales, que hiciera posible encontrar alguna pauta en comportamiento químico y sus propiedades. Durante los siguientes dos siglos se fue adquiriendo un mayor conocimiento sobre estas propiedades, así como descubriendo muchos elementos nuevos.
La palabra «elemento» procede de la ciencia griega, pero su noción moderna apareció a lo largo del siglo xvii, aunque no existe un consenso claro respecto al proceso que condujo a su consolidación y uso generalizado. Algunos autores citan como precedente la frase de Robert Boyle en su famosa obra El químico escéptico, donde denomina elementos «ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos». En realidad, esa frase aparece en el contexto de la crítica de Robert Boyle a los cuatro elementos aristotélicos.
A lo largo del siglo xviii, las tablas de afinidad recogieron un nuevo modo de entender la composición química, que aparece claramente expuesto por Lavoisier en su obra Tratado elemental de química. Todo ello condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlas.
El descubrimiento de gran cantidad de elementos nuevos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
Los pesos atómicos[editar]
A principios del siglo xix, John Dalton (1766-1844) desarrolló una concepción nueva del atomismo, a la que llegó gracias a sus estudios meteorológicos y de los gases de la atmósfera. Su principal aportación consistió en la formulación de un «atomismo químico» que permitía integrar la nueva definición de elemento realizada por Antoine Lavoisier (1743-1794) y las leyes ponderales de la química (proporciones definidas, proporciones múltiples, proporciones recíprocas).
Dalton empleó los conocimientos sobre proporciones en las que reaccionaban las sustancias de su época y realizó algunas suposiciones sobre el modo como se combinaban los átomos de las mismas. Estableció como unidad de referencia la masa de un átomo de hidrógeno (aunque se sugirieron otros en esos años) y refirió el resto de los valores a esta unidad, por lo que pudo construir un sistema de masas atómicas relativas. Por ejemplo, en el caso del oxígeno, Dalton partió de la suposición de que el agua era un compuesto binario, formado por un átomo de hidrógeno y otro de oxígeno. No tenía ningún modo de comprobar este punto, por lo que tuvo que aceptar esta posibilidad como una hipótesis a priori.
Dalton sabía que una parte de hidrógeno se combinaba con siete partes (ocho, afirmaríamos en la actualidad) de oxígeno para producir agua. Por lo tanto, si la combinación se producía átomo a átomo, es decir, un átomo de hidrógeno se combinaba con un átomo de oxígeno, la relación entre las masas de estos átomos debía ser 1:7 (o 1:8 se calcularía en la actualidad). El resultado fue la primera tabla de masas atómicas relativas (o pesos atómicos, como los llamaba Dalton), que fue posteriormente modificada y desarrollada en los años posteriores. Las inexactitudes antes mencionadas dieron lugar a toda una serie de polémicas y disparidades respecto a las fórmulas y los pesos atómicos, que solo comenzarían a superarse, aunque no totalmente, en el congreso de Karlsruhe en 1860.
Primeros intentos de sistematización[editar]
En 1789 Antoine Lavoisier publicó una lista de 33 elementos químicos, agrupándolos en gases, metales, no metales y tierras.10 Aunque muy práctica y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias tanto en las propiedades físicas como en las químicas.[cita requerida]
Los químicos pasaron el siglo siguiente buscando un esquema de clasificación más preciso. Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlos con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner (1780-1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos en los que se daba la misma relación —cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio—.
| Litio | LiCl LiOH | Calcio | CaCl2 CaSO4 | Azufre | H2S SO2 | ||||||
| Sodio | NaCl NaOH | Estroncio | SrCl2 SrSO4 | Selenio | H2Se SeO2 | ||||||
| Potasio | KCl KOH | Bario | BaCl2 BaSO4 | Telurio | H2Te TeO2 |
A estos grupos de tres elementos se los denominó tríadas. Al clasificarlas, Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al del elemento en medio.11 Esto se conoció como la Ley de Tríadas.12Por ejemplo, para la tríada cloro - bromo - yodo, los pesos atómicos son respectivamente 36, 80 y 127; el promedio es 81, que es aproximadamente 80; el elemento con el peso atómico aproximado a 80 es el bromo, lo cual hace que concuerde con el aparente ordenamiento de tríadas.
El químico alemán Leopold Gmelin trabajó con este sistema, y en 1843 había identificado diez tríadas, tres grupos de cuatro, y un grupo de cinco. Jean-Baptiste Dumas publicó el trabajo en 1857 que describe las relaciones entre los diversos grupos de metales. Aunque los diversos químicos fueron capaces de identificar las relaciones entre pequeños grupos de elementos, aún tenían que construir un esquema que los abarcara a todos.11
En 1857 el químico alemán August Kekulé observó que el carbono está a menudo unido a otros cuatro átomos. El metano, por ejemplo, tiene un átomo de carbono y cuatro átomos de hidrógeno.13 Este concepto eventualmente se conocería como «valencia».14
En 1862 de Chancourtois, geólogo francés, publicó una primera forma de tabla periódica que llamó la «hélice telúrica» o «tornillo». Fue la primera persona en notar la periodicidad de los elementos. Al disponerlos en espiral sobre un cilindro por orden creciente de peso atómico, de Chancourtois mostró que los elementos con propiedades similares parecían ocurrir a intervalos regulares. Su tabla incluye además algunos iones y compuestos. También utiliza términos geológicos en lugar de químicos y no incluye un diagrama; como resultado, recibió poca atención hasta el trabajo de Dmitri Mendeléyev.15
En 1864 Julius Lothar Meyer, un químico alemán, publicó una tabla con 44 elementos dispuestos por valencia. La misma mostró que los elementos con propiedades similares a menudo compartían la misma valencia.16 Al mismo tiempo, William Odling —un químico inglés— publicó un arreglo de 57 elementos ordenados en función de sus pesos atómicos. Con algunas irregularidades y vacíos, se dio cuenta de lo que parecía ser una periodicidad de pesos atómicos entre los elementos y que esto estaba de acuerdo con «las agrupaciones que generalmente recibían».17 Odling alude a la idea de una ley periódica, pero no siguió la misma.18 En 1870 propuso una clasificación basada en la valencia de los elementos.19
Ley de las octavas de Newlands[editar]
El químico inglés John Newlands produjo una serie de documentos de 1863 a 1866 y señaló que cuando los elementos se enumeran en orden de aumentar el peso atómico, las propiedades físicas y químicas similares se repiten a intervalos de ocho.n. 2
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Li 6,9 Na 23,0 K 39,0 | Be 9,0 Mg 24,3 Ca 40,0 | B 10,8 Al 27,0 | C 12,0 Si 28,1 | N 14,0 P 31,0 | O 16,0 S 32,1 | F 19,0 Cl 35,5 |
Comparó esta periodicidad con las octavas de la música.20 21 Esta llamada «ley de las octavas» fue ridiculizada por los contemporáneos de Newlands y la Chemical Society se negó a publicar su obra,22 porque dejaba de cumplirse a partir del calcio. Newlands fue sin embargo capaz de elaborar una tabla de los elementos y la utilizó para predecir la existencia de elementos faltantes, como el germanio.23 La Chemical Society solamente reconoció la importancia de sus descubrimientos cinco años después de que se le acreditaran a Mendeléyev,24 y posteriormente fue reconocido por la Royal Society, que le concedió a Newlands su más alta condecoración, la medalla Davy.[cita requerida]
En 1867 Gustavus Hinrichs, un químico danés, publicó un sistema periódico en espiral sobre la base de los espectros, los pesos atómicos y otras similitudes químicas. Su trabajo fue considerado como idiosincrásico, ostentoso y laberíntico y esto puede haber llevado a que se desaconsejase su reconocimiento y aceptación.25 26
Tabla periódica de Mendeléyev[editar]
En 1869, el profesor de química ruso Dmitri Ivánovich Mendeléyev publicó su primera Tabla Periódica en Alemania. Un año después Julius Lothar Meyer27publicó una versión ampliada de la tabla que había creado en 1864, basadas en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos.28 29
Por esta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza. Ambos químicos colocaron los elementos por orden creciente de sus masas atómicas, los agruparon en filas o periodos de distinta longitud y situaron en el mismo grupo elementos que tenían propiedades químicas similares, como la valencia. Construyeron sus tablas haciendo una lista de los elementos en filas o columnas en función de su peso atómico y comenzando una nueva fila o columna cuando las características de los elementos comenzaron a repetirse.30
El reconocimiento y la aceptación otorgada a la tabla de Mendeléyev vino a partir de dos decisiones que tomó. La primera fue dejar huecos cuando parecía que el elemento correspondiente todavía no había sido descubierto.31 No fue el primero en hacerlo, pero sí en ser reconocido en el uso de las tendencias en su tabla periódica para predecir las propiedades de esos elementos faltantes.32 Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka-aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka-silicio; el escandio (Sc); y el tecnecio (Tc), que, aislado químicamente a partir de restos de un sincrotrón en 1937, se convirtió en el primer elemento producido de forma predominantemente artificial.
La segunda decisión fue ignorar el orden sugerido por los pesos atómicos y cambiar los elementos adyacentes, tales como telurio y yodo, para clasificarlos mejor en familias químicas. En 1913, Henry Moseley determinó los valores experimentales de la carga nuclear o número atómico de cada elemento, y demostró que el orden de Mendeléyev corresponde efectivamente al que se obtiene de aumentar el número atómico.33
El significado de estos números en la organización de la tabla periódica no fue apreciado hasta que se entendió la existencia y las propiedades de los protones y los neutrones. Las tablas periódicas de Mendeléyev utilizan el peso atómico en lugar del número atómico para organizar los elementos, información determinable con precisión en ese tiempo. El peso atómico funcionó bastante bien para la mayoría de los casos permitiendo predecir las propiedades de los elementos que faltan con mayor precisión que cualquier otro método conocido entonces. Moseley predijo que los únicos elementos que faltaban entre aluminio (Z = 13) y oro (Z = 79) eran Z = 43, 61, 72 y 75, que fueron descubiertos más tarde. La secuencia de números atómicos todavía se utiliza hoy en día incluso aunque se han descubierto y sintetizado nuevos elementos.34
Segunda tabla periódica de Mendeléyev y desarrollos posteriores[editar]
En 1871, Mendeléyev publicó su tabla periódica en una nueva forma, con grupos de elementos similares dispuestos en columnas en lugar de filas, numeradas I a VIII en correlación con el estado de oxidación del elemento. También hizo predicciones detalladas de las propiedades de los elementos que ya había señalado que faltaban, pero deberían existir.35 Estas lagunas se llenaron posteriormente cuando los químicos descubrieron elementos naturales adicionales.36
En su nueva tabla consigna el criterio de ordenación de las columnas se basan en los hidruros y óxidos que puede formar esos elementos y por tanto, implícitamente, las valencias de esos elementos. Aún seguía dando resultados contradictorios (Plata y Oro aparecen duplicados, y no hay separación entre Berilio y Magnesio con Boro y Aluminio), pero significó un gran avance. Esta tabla fue completada con un grupo más, constituido por los gases nobles descubiertos en vida de Mendeléyev, pero que, por sus características, no tenían cabida en la tabla, por lo que hubo de esperar casi treinta años, hasta 1904, con el grupo o valencia cero, quedando la tabla más completa.
A menudo se afirma que el último elemento natural en ser descubierto fue el francio —designado por Mendeléyev como eka-cesio— en 1939.37 Sin embargo, el plutonio, producido sintéticamente en 1940, fue identificado en cantidades ínfimas como un elemento primordial de origen natural en 1971.38
La disposición de la tabla periódica estándar39 es atribuible a Horace Groves Deming, un químico americano que en 1923 publicó una tabla periódica de 18 columnas.40 En 1928 Merck and Company preparó un folleto con esta tabla, que fue ampliamente difundida en las escuelas estadounidenses. Por la década de 1930 estaba apareciendo en manuales y enciclopedias de química. También se distribuyó durante muchos años por la empresa Sargent-Welch Scientific Company.41 42 43
Mecánica cuántica y expansión progresiva de la tabla[editar]
La tabla periódica de Mendeléyev presentaba ciertas irregularidades y problemas. En las décadas posteriores tuvo que integrar los descubrimientos de los gases nobles, las «tierras raras» y los elementos radioactivos. Otro problema adicional eran las irregularidades que existían para compaginar el criterio de ordenación por peso atómico creciente y la agrupación por familias con propiedades químicas comunes. Ejemplos de esta dificultad se encuentran en las parejas telurio-yodo, argón-potasio y cobalto-níquel, en las que se hace necesario alterar el criterio de pesos atómicos crecientes en favor de la agrupación en familias con propiedades químicas semejantes.
Durante algún tiempo, esta cuestión no pudo resolverse satisfactoriamente hasta que Henry Moseley (1867-1919) realizó un estudio sobre los espectros de rayos X en 1913. Moseley comprobó que al representar la raíz cuadrada de la frecuencia de la radiación en función del número de orden en el sistema periódico se obtenía una recta, lo cual permitía pensar que este orden no era casual sino reflejo de alguna propiedad de la estructura atómica. Hoy sabemos que esa propiedad es el número atómico (Z) o número de cargas positivas del núcleo.
La explicación que se acepta actualmente de la ley periódica surgió tras los desarrollos teóricos producidos en el primer tercio del siglo XX, cuando se construyó la teoría de la mecánica cuántica. Gracias a estas investigaciones y a desarrollos posteriores, se acepta que la ordenación de los elementos en el sistema periódico está relacionada con la estructura electrónica de los átomos de los diversos elementos, a partir de la cual se pueden predecir sus diferentes propiedades químicas.44
En 1945 Glenn Seaborg, un científico estadounidense, sugirió que los actínidos, como los lantánidos, estaban llenando un subnivel f en vez de una cuarta fila en el bloque d, como se pensaba hasta el momento. Los colegas de Seaborg le aconsejaron no publicar una teoría tan radical, ya que lo más probable era arruinar su carrera. Como consideraba que entonces no tenía una carrera que pudiera caer en descrédito, la publicó de todos modos. Posteriomente se encontró que estaba en lo cierto y en 1951 ganó el Premio Nobel de Química por su trabajo en la síntesis de los actínidos.45 46 n. 3
En 1952, el científico costarricense Gil Chaverri presentó una nueva versión basada en la estructura electrónica de los elementos, la cual permite ubicar las series de lantánidos y actínidos en una secuencia lógica de acuerdo con su número atómico.48
Aunque se producen de forma natural pequeñas cantidades de algunos elementos transuránicos,7 todos ellos fueron descubiertos por primera vez en laboratorios, el primero de los cuales fue el neptunio, sintetizado en 1939. La producción de estos elementos ha expandido significativamente la tabla periódica.49 Debido a que muchos son altamente inestables y decaen rápidamente, son difíciles de detectar y caracterizar cuando se producen. Han existido controversias relativas a la aceptación de las pretensiones y derechos de descubrimiento de algunos elementos, lo que requiere una revisión independiente para determinar cuál de las partes tiene prioridad, y por lo tanto los derechos del nombre. Flerovio (elemento 114) y livermorio (elemento 116) fueron nombrados el 31 de mayo de 2012.50 En 2010, una colaboración conjunta entre Rusia y Estados Unidos en Dubná, región de Moscú, Rusia, afirmó haber sintetizado seis átomos de teneso (elemento 117).51
El 30 de diciembre de 2015 la IUPAC reconoció oficialmente los elementos 113, 115, 117, y 118, completando la séptima fila de la tabla periódica.52 El 28 de noviembre de 2016 se anunciaron los nombres oficiales y los símbolos de los últimos cuatro nuevos elementos aprobados hasta la fecha por la IUPAC (Nh, nihonio; Mc, moscovio; Ts, teneso; y Og, oganesón),1 que sustituyen a las designaciones temporales.
Estructura y organización de la tabla periódica[editar]
La tabla periódica actual es un sistema donde se clasifican los elementos conocidos hasta la fecha. Se colocan de izquierda a derecha y de arriba abajo en orden creciente de sus números atómicos. Los elementos están ordenados en siete hileras horizontales llamadas periodos, y en 18 columnas verticales llamadas grupos o familias.53
Hacia abajo y a la izquierda aumenta el radio atómico y el radio iónico.
Hacia arriba y a la derecha aumenta la energía de ionización, la afinidad electrónica y la electronegatividad.
Grupos[editar]
A las columnas verticales de la tabla periódica se las conoce como grupos o familias. Hay 18 grupos en la tabla periódica estándar. En virtud de un convenio internacional de denominación, los grupos están numerados de 1 a 18 desde la columna más a la izquierda —los metales alcalinos— hasta la columna más a la derecha —los gases nobles—.54Anteriormente se utilizaban números romanos según la última cifra del convenio de denominación de hoy en día —por ejemplo, los elementos del grupo 4 estaban en el IVB y los del grupo 14 en el IVA—. En Estados Unidos, los números romanos fueron seguidos por una letra «A» si el grupo estaba en el bloque s o p, o una «B» si pertenecía al d. En Europa, se utilizaban letras en forma similar, excepto que «A» se usaba si era un grupo precedente al 10, y «B» para el 10 o posteriores. Además, solía tratarse a los grupos 8, 9 y 10 como un único grupo triple, conocido colectivamente en ambas notaciones como grupo VIII. En 1988 se puso en uso el nuevo sistema de nomenclatura IUPAC se pone en uso, y se desecharon los nombres de grupo previos.55
Algunos de estos grupos tienen nombres triviales —no sistemáticos—, como se ve en la tabla de abajo, aunque no siempre se utilizan. Los grupos del 3 al 10 no tienen nombres comunes y se denominan simplemente mediante sus números de grupo o por el nombre de su primer miembro —por ejemplo, «el grupo de escandio» para el 3—, ya que presentan un menor número de similitudes y/o tendencias verticales.54
|
La explicación moderna del ordenamiento en la tabla periódica es que los elementos de un grupo poseen configuraciones electrónicas similares y la misma valencia, entendida como el número de electrones en la última capa. Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que están ubicados en los niveles más externos, los elementos de un mismo grupo tienen propiedades químicas similares y muestran una tendencia clara en sus propiedades al aumentar el número atómico.56
Por ejemplo, los elementos en el grupo 1 tienen una configuración electrónica ns1 y una valencia de 1 —un electrón externo— y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía —regla del octeto— y, por ello, son excepcionalmente no reactivos y son también llamados «gases inertes».
Los elementos de un mismo grupo tienden a mostrar patrones en el radio atómico, energía de ionización y electronegatividad. De arriba abajo en un grupo, aumentan los radios atómicos de los elementos. Puesto que hay niveles de energía más llenos, los electrones de valencia se encuentran más alejados del núcleo. Desde la parte superior, cada elemento sucesivo tiene una energía de ionización más baja, ya que es más fácil quitar un electrón en los átomos que están menos fuertemente unidos. Del mismo modo, un grupo tiene una disminución de electronegatividad desde la parte superior a la inferior debido a una distancia cada vez mayor entre los electrones de valencia y el núcleo.57
Hay excepciones a estas tendencias, como por ejemplo lo que ocurre en el grupo 11, donde la electronegatividad aumenta más abajo en el grupo.58 Además, en algunas partes de la tabla periódica como los bloques d y f, las similitudes horizontales pueden ser tan o más pronunciadas que las verticales.59 60 61
Períodos[editar]
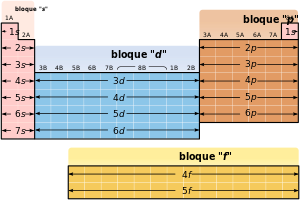
Las filas horizontales de la tabla periódica son llamadas períodos.62 El número de niveles energéticos de un átomo determina el periodo al que pertenece. Cada nivel está dividido en distintos subniveles, que conforme aumenta su número atómico se van llenando en este orden:
| 1s | |||||
| 2s | 2p | ||||
| 3s | 3p | ||||
| 4s | 3d | 4p | |||
| 5s | 4d | 5p | |||
| 6s | 4f | 5d | 6p | ||
| 7s | 5f | 6d | 7p |
Siguiendo esa norma, cada elemento se coloca según su configuración electrónica y da forma a la tabla periódica.
Los elementos en el mismo período muestran tendencias similares en radio atómico, energía de ionización, afinidad electrónica y electronegatividad. En un período el radio atómico normalmente decrece si nos desplazamos hacia la derecha debido a que cada elemento sucesivo añadió protones y electrones, lo que provoca que este último sea arrastrado más cerca del núcleo.63 Esta disminución del radio atómico también causa que la energía de ionización y la electronegatividad aumenten de izquierda a derecha en un período, debido a la atracción que ejerce el núcleo sobre los electrones.57 La afinidad electrónica también muestra una leve tendencia a lo largo de un período. Los metales —a la izquierda— generalmente tienen una afinidad menor que los no metales —a la derecha del período—, excepto para los gases nobles.64
La tabla periódica consta de 7 períodos:
Bloques[editar]
La tabla periódica se puede también dividir en bloques de acuerdo a la secuencia en la que se llenan las capas de electrones de los elementos. Cada bloque se denomina según el orbital en el que el en teoría reside el último electrón: s, p, d y f.65 n. 4 El bloque s comprende los dos primeros grupos (metales alcalinos y alcalinotérreos), así como el hidrógeno y el helio. El bloque p comprende los últimos seis grupos —que son grupos del 13 al 18 en la IUPAC (3A a 8A en América)— y contiene, entre otros elementos, todos los metaloides. El bloque d comprende los grupos 3 a 12 —o 3B a 2B en la numeración americana de grupo— y contiene todos los metales de transición. El bloque f, a menudo colocado por debajo del resto de la tabla periódica, no tiene números de grupo y se compone de lantánidos y actínidos.66 Podría haber más elementos que llenarían otros orbitales, pero no se han sintetizado o descubierto; en este caso se continúa con el orden alfabético para nombrarlos. Así surge el bloque g, que es un bloque hipotético.
Metales, metaloides y no metales[editar]
De acuerdo con las propiedades físicas y químicas que comparten, los elementos se pueden clasificar en tres grandes categorías: metales, metaloides y no metales. Los metales son sólidos generalmente brillantes, altamente conductores que forman aleaciones de unos con otros y compuestos iónicos similares a sales con compuestos no metálicos —siempre que no sean los gases nobles—. La mayoría de los no metales son gases incoloros o de colores; pueden formar enlaces covalentes con otros elementos no metálicos. Entre metales y no metales están los metaloides, que tienen propiedades intermedias o mixtas.67
Metales y no metales pueden clasificarse en sub_categorías que muestran una gradación desde lo metálico a las propiedades no metálicas, de izquierda a derecha, en las filas: metales alcalinos —altamente reactivos—, metales alcalinotérreos —menos reactivos—, lantánidos y actínidos, metales de transición y metales post-transición. Los no metales se subdividen simplemente en no metales poliatómicos —que, por estar más cercanos a los metaloides, muestran cierto carácter metálico incipiente—, no metales diatómicos —que son esencialmente no metálicos— y los gases nobles, que son monoatómicos no metálicos y casi completamente inertes. Ocasionalmente también se señalan subgrupos dentro de los metales de transición, tales como metales refractarios y metales nobles.68 and occasionally denoted.69
La colocación de los elementos en categorías y subcategorías en función de las propiedades compartidas es imperfecta. Hay un espectro de propiedades dentro de cada categoría y no es difícil encontrar coincidencias en los límites, como es el caso con la mayoría de los sistemas de
clasificación.70 El berilio, por ejemplo, se clasifica como un metal alcalinotérreo, aunque su composición química anfótera y su tendencia a formar compuestos covalentes son dos atributos de un metal de transición químicamente débil o posterior. El radón se clasifica como un no metal y un gas noble aunque tiene algunas características químicas catiónicas más características de un metal. También es posible clasificar con base en la división de los elementos en categorías de sucesos, mineralógicos o estructuras cristalinas. La categorización de los elementos de esta forma se remonta a por lo menos 1869, cuando Hinrichs escribió que se pueden extraer líneas sencillas de límites para mostrar los elementos que tienen propiedades similares, tales como metales y no metales, o los elementos gaseosos.71
SACADO DE WIKIPEDIA LIBRE ENCICLOPEDIA.


No hay comentarios:
Publicar un comentario